Publications :
1. Baumann M., Mozer P, Daanen V, Troccaz J., Prostate biopsy tracking with deformation estimation. Med Image Anal. 2012 Apr ;16(3):562-76. doi : 10.1016/j.media.2011.01.008. Epub 2011 May 17.
2. Fiard G, Hohn N, Descotes JL, Rambeaud JJ, Troccaz J, Long JA. Targeted MRI-guided prostate biopsies for the detection of prostate cancer : initial clinical experience with real-time 3-dimensional transrectal ultrasound guidance and magnetic resonance/transrectal ultrasound image fusion. Urology. 2013 Jun ;81(6):1372-8. doi : 10.1016/j.urology.2013.02.022. Epub 2013 Mar 26.
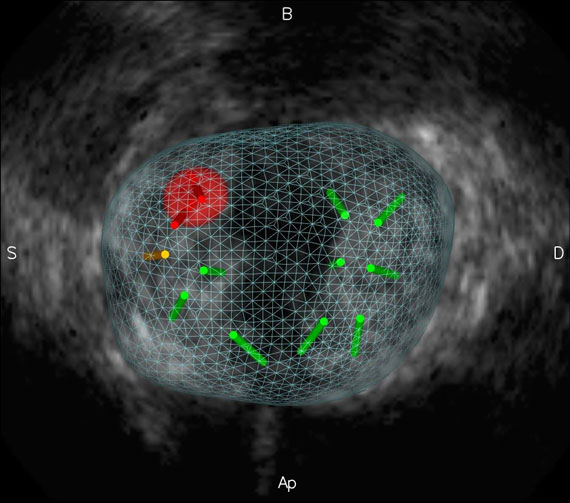
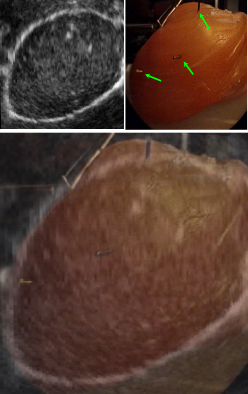
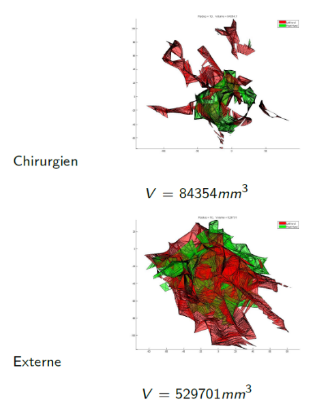
3. Cécilia Lanchon, Guillaume Custillon, Alexandre Moreau-Gaudry, Jean-Luc Descotes, Jean-Alexandre Long et al. Augmented Reality Using Transurethral Ultrasound for Laparoscopic Radical Prostatectomy : Preclinical Evaluation. Journal of Urology, Elsevier, 2016, 196 (1), pp.244-50. 〈10.1016/j.juro.2016.01.094〉
4. Sandrine Voros, Alexandre Moreau-Gaudry, Brahim Tamadazte, Guillaume Custillon, Redha Heus et al. Devices and systems targeted towards augmented robotic radical prostatectomy, IRBM, Elsevier Masson, 2013, 34 (2), pp.139-146. 〈10.1016/j.irbm.2013.01.014〉
5. Rémi Wolf, Quantification de la qualité d’un geste chirurgical à partir de connaissances a priori, thèse de doctorat sous la direction de Sandrine Voros et Philippe Cinquin. Médecine humaine et pathologie. Université de Grenoble, 2013.